Compuestos y Números de Oxidación
Los Números de Oxidación ó también llamados Valencias o Estados de Oxidación, son números enteros que representan el número de electrones que un átomo pone en juego cuando forma un compuesto determinado.
El número de oxidación es positivo si el átomo pierde electrones, o los comparte con un átomo que tenga tendencia a captarlos.
Y será negativo cuando el átomo gane electrones, o los comparta con un átomo que tenga tendencia a cederlos.
El número de oxidación se escribe de la siguiente manera: +1, +2, +3, +4, –1, –2, –3, –4, etc.
Relación del numero de Oxidación y la configuración Electrónica
Grupo Número de Oxidación
IA +1
IIA +2
IIIB +3
El resto de elementos generalmente pueden tener dos o más números de oxidación positivos, en términos generales:
- Columna par números de oxidación par.
- Columna impar números de oxidación impar.
El número de oxidación negativo corresponde a la cantidad de electrones que el elemento necesita para completar el octeto electrónico.
Es un solo número y lo presentan por lo general los no metales, a excepción del boro y el silicio que no presentan número de oxidación negativo.
Reglas para determinar números de oxidación
Reglas para asignar los Números de Oxidación de los Elementos:
1. El Número de Oxidación de todos los Elementos en Estado Libre, no combinados con otros, es cero (p. ej., Na, Cu, Mg, H2, O2, Cl2, N2).
2. El Número de Oxidación del Hidrógeno (H) es de +1, excepto en los hidruros metálicos (compuestos formados por H y algún metal), en los que es de -1 (p. ej., NaH, CaH2).
3. El Número de Oxidación del Oxígeno (O) es de -2, excepto en los peróxidos, en los que es de -1, y en el OF2, donde es de +2.
4. El Número de Oxidación de los Metales, es su valencia con signo positivo. Por ejemplo, el Número de Oxidación del Mg2+ es +2.
5. El Número de Oxidación de los Iones monoatómicos coincide con la carga del ión. Por ejemplo, el Número de Oxidación del Cl- es -1
6. La Suma algebraica de los Números de Oxidación de los elementos de un compuesto es cero.
7. La Suma algebraica de los Números de Oxidación de los elementos de un ion poliatómico es igual a la carga del ion.
Además, en los Compuestos Covalentes, el Número de Oxidación Negativo se asigna al Átomo más electronegativo y todos los demás son Positivos.
EJERCITEMOS
Deducir los Números de Oxidación de cada uno de los Elementos presentes en los siguientes compuestos:
a) H2
b)H2O
c) MnO4-
a) Para el H2 (Hidrógeno molecular): Aplicando la regla 1, sabemos que el Hidrógeno en la molécula de Hidrógeno Molecular tiene número de oxidación 0.
b) Para el H2O (Molécula de agua): Aplicando la regla 3, sabemos que el O tendrá número de oxidación -2, por lo tanto el H deberá tener número de oxidación +1 para que se cumpla la regla 6 ( (+1) x 2 + (-2) = 0).
Esto tiene sentido, si observamos la regla 2 que dice que el H siempre tiene número de oxidación +1 excepto en los hidruros metálicos (el agua NO es un hidruro metálico).
c) Para el MnO4- (Ion Permanganato que es un ion Poliatómico): Aplicando la regla 3, sabemos que el O tendrá número de oxidación -2.
Según la regla 7, la suma de los números de oxidación de los elementos de un ion poliatómico es igual a la carga del ion, es decir, en este caso deberá ser igual a -1.
Para que esto ocurra, el número de oxidación del Manganeso (Mn) deberá ser +7.
Si nos fijamos en la tabla periódica, ese es uno de los números de oxidación posibles del Manganeso. Ahora, confirmemos que la regla 7 se ha cumplido: (+7) + 4 x (-2) = -1.
Predicción de Formulas con números de Oxidación
El conocimiento de los números de oxidación ayuda a predecir las fórmulas de los compuestos químicos.
Una formula química consiste en la unión de elementos de números de oxidación positivo con elementos de número de oxidación negativo.
La suma de todos los números de oxidación de la fórmula final debe ser cero.
¿Cuáles serán las fórmulas posibles para el compuesto formado por calcio y azufre?
- Ca 2 S 2 --> Ca S
- Ca 4 S 2 --> Ca 2 S
- Ca 6 S2 --> Ca 3 S
- Al 3 N 3 --> Al N
Los compuestos no son combinaciones al azar de los elementos de la Tabla Periódica. Son el resultado de la combinación, en determinadas proporciones, de elementos que guardan entre sí una cierta “afinidad”.
Depende de: Capacidad de combinación o valencia de los elementos que, a su vez, es función de la estructura electrónica de los átomos implicados.
Consideraciones Importantes
Sustancias Simples
Son aquellas que están constituidas por átomos de un solo elemento. En ellas las moléculas están formadas por átomos idénticos. En general, muchos elementos que son gases suelen encontrarse en forma diatómica (N2, O2, H2, etc.).
Otro fenómeno curioso es que ciertos elementos (azufre, fósforo, etc.) se presentan, a veces, en agrupaciones de distinto número de átomos, estas agrupaciones se denominan formas alotrópicas.
- Oxígeno molecular (O2)
- Una pepita de oro (Au)
- Fósforo (P)
- Nitrógeno molecular (N2)
- Cloro gas (Cl2)
- Carbono (C)
- Hidrógeno (H2)
Deben nombrarse como óxidos tanto las combinaciones de oxígeno con metales como con no metales.
Para formularlos se escribe siempre, a la izquierda, el elemento más electropositivo, intercambiándose los números de oxidación del oxígeno (-2) y del otro elemento.
- CaO --> Óxido de calcio
- Al2O3 --> Óxido de aluminio
- SiO2 --> Óxido de silicio
- MgO --> Óxido de magnesio
Las combinaciones del hidrógeno con metales se denominan hidruros.
- NaH --> Hidruro de sodio
- GaH3 --> Hidruro de galio
- KH --> Hidruro de potasio
- GeH4 --> Hidruro de germanio
- PH3 --> Fosfina
- AsH3 --> Arsina
- SbH3 --> Estibina
- CH4 --> Metano
- HBr --> Bromuro de hidrógeno--> Ácido bromhídrico
- HI --> Yoduro de hidrógeno --> Ácido yodhídrico
- H2S --> Sulfuro de hidrógeno --> Ácido sulfhídrico
- H2Se --> Seleniuro de hidrógeno --> Ácido selenhídrico
Las combinaciones binarias, que no sean ni óxidos ni hidruros, son las formadas por no metales con metales.
Para formularlos se escribe a la izquierda el símbolo del metal, por ser el elemento más electropositivo.
Para nombrarlos se le añade al nombre del no metal el sufijo –uro.
- CaF2 --> Fluoruro de calcio
- FeCl2 --> Cloruro de hierro(II)
- FeCl3 --> Cloruro de hierro(III)
- CuBr --> Bromuro de cobre(I)
ANHIDRIDOS
Producto de la reacción del oxígeno con un elemento no metálico y con algunos metales de transición.
• Forman anhidridos los no metales de columna IV A y VI A cuando trabajan con número de oxidación PARES. Cuando lo hacen con IMPARES, forman óxidos.
• Los no metales de la familia VA y VIIA forman anhídridos cuando trabajan con número de oxidación IMPARES, y forman óxidos cuando lo hacen con PARES
• Cuando el elemento solo forma una anhídrido. El nombre se forma con el nombre del no metal terminado en “ICO”
|
No.
de oxidación del no metal |
Prefijos |
Sufijos |
|
1 o 2 |
Hipo |
Oso |
|
3 o 4 |
--- |
Oso |
|
5 o 6 |
--- |
Ico |
|
7 |
Per |
Ico |
Ácidos Oxoácidos
Son compuestos capaces de ceder protones que contienen oxígeno en la molécula.
Presentan la fórmula general --> HaXbOc
Oxoacidos del Grupo de los Halógenos
Los halógenos que forman oxoácidos son: cloro, bromo y yodo. En los tres casos los números de oxidación pueden ser +I, +III, +V y +VII. Al tener más de dos estados de oxidación junto a las terminaciones –oso e –ico, utilizaremos los prefijos hipo– (que quiere decir menos que) y per– (que significa superior).
- HClO3 --> Ácido clórico
- HClO4 --> Ácido perclórico
- HBrO --> Ácido hipobromoso
- HBrO2 --> Ácido bromoso
De los oxoácidos de azufre, selenio y teluro, los más representativos son aquellos en los que el número de oxidación es +IV y +VI. Para estos ácidos se utilizan los sufijos –oso e –ico.
- H2SO3 --> Ácido sulfuroso
- H2SO4 --> Ácido sulfúrico
- H2SeO3 --> Ácido selenioso
- H2SeO4 --> Ácido selénico
Los ácidos más comunes del nitrógeno son el ácido nitroso y el ácido nítrico en los que el nitrógeno presenta número de oxidación +III y +V, respectivamente.
- HNO2 --> Ácido nitroso
- HNO3 --> Ácido nítrico
El estado de oxidación, en ambos casos, es de +IV. Los oxoacidos más comunes son:
- H2CO3 --> Ácido carbónico
- H4SiO4 --> Ácido ortosilícico
Podemos considerar como sales los compuestos que son el resultado de la unión de una especie catiónica cualquiera con una especie aniónica distinta de H–, OH– y O2–. 6
• Algunas sales ya las hemos visto cuando tratamos de las combinaciones binarias no metal–metal. Por ejemplo, compuestos como el KCl (cloruro de potasio) y Na2S (sulfuro de sodio) son sales.
• Cuando el anión procede de un oxoácido debemos recordar que, los aniones llevan el sufijo –ito o – ato según del ácido del que procedan.
• Para nombrar las sales basta tomar el nombre del anión y añadirle detrás el nombre del catión.
|
Sal
|
Oxoanion
de procedencia |
Nombre |
|
NaClO |
ClO– |
Hipoclorito
de sodio |
|
NaClO3 |
NaClO3 |
Clorato
de sodio |
|
K2SO3 |
SO3 –2 |
Sulfito de
potasio |
SALES DOBLES
Son sales que contienen más de un catión o más de un anión. Las sales dobles son compuestos cuaternarios . Se forman cuando al menos dos sales se disuelven en un mismo líquido y cristalizan de forma regular.
Estas sales dobles se forman mediante dos metales, donde se utilizan consecuentemente para formar la sal.
- KNaSO4 --> Sulfato doble de potasio y sodio
- KNH4SO3 --> Sulfito doble de potasio y amonio
Son compuestos que se obtienen cuando a un ácido se le sustituyen sus átomos de hidrógeno por radicales básicos, que en el caso específico de las sales ácidas, son de tipo negativo (cationes). En eso se distinguen de las sales neutras o sales binarias.
Las sales se forman usualmente a través de la reacción entre un ácido y un hidróxido (base). En estas reacciones, normalmente la base pierde sus grupos hidroxilo (-OH) y el ácido los átomos de hidrógeno (H), formando una sal neutra; pero si el ácido en cuestión conserva uno de sus átomos de hidrógeno, alterando la carga eléctrica de la reacción, obtendremos una sal ácida o sal hidrogenada.
 POR EJEMPLO
POR EJEMPLO- Bicarbonato de sodio (NaHCO3).
- Bicarbonato de litio (LiHCO3).
- Hidrogenofosfato de calcio (CaHPO4).
Se forman cuando en una reacción de neutralización existe un exceso de hidróxido con respecto al ácido.
Son compuestos cauternarios (no metal, hidrógeno, oxígeno y metal) que se producen en una reacción de neutralización en la que existe un exceso de hidróxido respecto del ácido por lo que resultan de resultan de reemplazar parcialmente los oxhidrilos de un hidróxido o base por los aniones de un ácido, por lo que la base ha de contener más de un grupo hidróxido.
Ácido + base (exceso) → sal básica + agua
POR EJEMPLO
- CaOHNO3 Nitrato básico de calcio
- BiOH(NO3)2 Nitrato monobásico de Bismuto (III)
- Bi(OH)2NO3 Nitrato dibásico de bismuto
HIDROXIDOS
Son compuestos formados por la combinación del anión hidroxilo(OH-) con diversos cationes metálicos.
Los hidróxidos se formulan escribiendo el metal seguido del grupo dependiente con la base de un ion de radical adecuado con hidróxido; este va entre paréntesis si el subíndice es mayor de uno. Dicho de otro modo, se escribe primero el metal y luego el grupo funcional OH, (ion hidróxido, OH-), denominado grupo hidroxilo, que actúa con número de oxidación -1.
- LiOH Hidróxido de litio Ba(OH)2
- Hidróxido de bario
- Fe(OH)2 Hidróxido de hierro (II)
CATIONES
Cuando un átomo pierde electrones (los electrones de sus orbitales más externos, también llamados electrones de valencia) adquiere, como es lógico, una carga positiva neta.
• Para nombrar estas “especies químicas” basta anteponer la palabra catión o ión al nombre del elemento.
- H+ --> Ión hidrógeno
- Li+ --> Ión litio
- Cu+ --> Ión cobre (I)
- Cu+2 --> Ión cobre (II)
ANIONES
Se llaman aniones a las “especies químicas” cargadas negativamente. Los aniones más simples son los monoatómicos, que proceden de la ganancia de uno o más electrones por un elemento electronegativo. • Para nombrar los iones monoatómicos se utiliza la terminación –uro.
- H– Ión hidruro
- S–2 Ión sulfuro
- F– Ión fluoruro
- Se–2 Ión seleniuro
Los peróxidos son compuestos formados por el grupo “peroxo”:
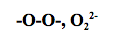
También, por cualquier otro elemento menos electronegativo que el oxígeno (como por ejemplo los metales).
Dentro de la Nomenclatura tradicional, se nombran con la palabra peróxido seguida del elemento metálico teniendo en cuenta la valencia del elemento metálico.
- Na2O2 Peróxido de sodio
- BaO2 Peróxido de bario
- CuO2 Peróxido de cobre (II)
PEROXOACIDOS
Son moléculas derivadas de los oxoácidos en las cuales se ha sustituido un átomo de oxígeno (con estado de oxidación -2) por dos átomos de oxígeno (con estado de oxidación -1) que forman el grupo peroxo. La formulación de estas moléculas es análoga a los oxoácidos pero añadiendo el prefijo “peroxo”.
- HNO4 Peroxodioxonitrato (V) de hidrógeno.
- HOONO Peroxomonoxonitrat o (III) de hidrógeno.
¡VIDEO PARA APOYARNOS DE LA TEORIA! :)
CALCULOS DE FORMULAS
Recordemos un poco... MASA MOLAR
Es el cálculo de la masa de una fórmula. Para esto se usan los subíndices de las fórmulas y las masas individuales de los elementos Los subíndices nos indican cuantos átomos de un elemento están presentes en dicha fórmula y las masas de los elementos se encuentran en la tabla periódica. La dimensional para indicar la masa de un elemento son las uma.
Calcular la Masa Molar del metanol: CH3OH.
Las Masas Molares de H, C y O son: 1,008, 12,011 y 15,999 gramos / mol respectivamente.
Solución:
M (CH3OH) = M (C) + 4 · M (H) + M (O) = 12,011 + 4 · 1,008 + 15,999 = 32,042 gramos / mol.
M (H2SO4) = 2 · M (H) + M (S) + 4 · M (O) = 2 · 1,008 + 32,065 + 4 · 15,999 = 98,077 gramos / mol.
COMPOSICION PORCENTUAL DE UN COMPUESTO
Se define como el porcentaje por masa de cada elemento presente en el compuesto.
• Se calcula de la siguiente manera:
1) Determinando primero la masa de los diferentes elementos que forman el compuesto.
2) Después se determina la masa molar del compuesto
3) Por último se calcula el porcentaje de cada elemento del compuesto
Calcular la composición porcentual del H, S y O en el ácido sulfúrico (H2SO4) si su peso molecular es 98 y los pesos atómicos del H, S y del O son 1, 32 y 16 respectivamente:
Composición Porcentual del H = | 1 · 2 | = 2 % de Hidrógeno |
| 98 |
Composición Porcentual del S = | 32 · 1 | = 32,6% de Azufre |
| 98 |
Composición Porcentual del O = | 16 · 4 | = 65,3% de Oxígeno |
| 98 |
- Verificamos que la suma da 100%: 2 + 32,6 + 65,3 = 99,9 ≈ 100%
FORMULA QUIMICA
Las fórmulas químicas sirven para representar la composición de las moléculas y los compuestos iónicos por medio de símbolos químicos.
• Composición no significa solo los elementos presentes sino también las proporcioes en la cual se combinan los átomos.
• Hay 3 diferentes tipos de fórmulas:
• A. fórmula empírica
• B. fórmula molecular
• C fórmula Estructural
- Dióxido de carbono. CO2
- Monóxido de carbono. CO
- Agua. H2O
- Amoníaco. NH3
FORMULA EMPIRICA
Representa la fórmula más sencilla de un compuesto. Esta indica cuales elementos están presentes y la relación mínima en números enteros de los átomos de cada elemento que forman un compuesto pero no indica el número real de átomos de una molécula.
• Varios compuestos diferentes pueden tener la misma fórmula empírica por ejemplo
• CH es la fórmula empírica del: • acetileno --> C2H2
• Benceno --> C6H6
Calcula la fórmula empírica de un hidrocarburo que en un análisis dio la siguiente composición: 85,63% de C y 14,3% de H.
- 85,63% de C = 85,63 g de C
n = m/PM n= 85,63/12= 7,1358 moles (átomo gramo)
- 14,3% de H = 14,3 g de H
- n = m/PM
- n= 14,3/1= 14,3 moles (átomo gramo)
- C: 7,1358/ 7,1358=1 H: 14,3/7,1358=2 Por tanto tenemos C:1 H:2
- Fórmula empírica así: CH2
FORMULA MOLECULAR
Una fórmula molecular es la molécula real de un compuesto químico. Indica el número exacto de átomos de cada elemento que están presentes en la unidad más pequeña de una sustancia.
Las fórmulas moleculares proporcionan más información acerca de las moléculas que las fórmulas empíricas.
Siempre que conozcamos la fórmula molecular de un compuesto podremos determinar su fórmula empírica. En cambio, lo opuesto no se cumple; si conocemos la fórmula empírica de una sustancia no podremos determinar su fórmula molecular sin poseer más información.
- Representa la relación real entre os átomos.
- Como siempre los subíndices indican el número de átomos presentes de cada elemento dentro de la molécula
- El succinato de dibutilo es un repelente utilizado en casas para los insectos. Su composición es 62,58% de Carbono, 9,63% de Hidrógeno y 27,79% de Oxígeno. Si su peso molecular determinado experimentalmente es de 239g/mol, obtén su fórmula molecular.
- CARBONO = 62.58 /12.01 = 5.2106
- HIDROGENO = 9.63/1.01 = 9.53
- OXIGENO = 27.79/16 = 1.73
- Numero de átomos de Carbono: 5.21/ 1.73 = 3
- Numero de átomos de hidrogeno: 9.53/1.73 = 5.5
- Numero de átomos de Oxigeno: 31.73/1.73 = 1
La fórmula empírica del compuesto es C3H5,5O1. Redondeamos los subíndices multiplicando todos los elementos por 2 y la fórmula empírica nos queda finalmente: C6H11O2
Para obtener la fórmula molecular tenemos que relacionar el peso molecular de ésta (PMc) con el peso molecular de la fórmula empírica.
- FE: 6 * 12,02 + 11 * 1.01 + 2 *16 = 115.117 g/mol
REFERENCIAS
- Marroquín T. (2021) Formulas Quimicas, Empiricas y Moleculares.
- Moran Morales (2012) Formula quimica y molecular. https://www.quimicas.net/2015/10/calculo-de-composicion-porcentual.html
- Lopez Lozano (2018) Formulas quimicas. https://concepto.de/formula-quimica/#:~:text=Una%20f%C3%B3rmula%20qu%C3%ADmica%20es%20una,enlaces%20qu%C3%ADmicos%20que%20los%20unen.
- Zita Pisano (2012) Compuestos y Sustancias quimicas https://www.diferenciador.com/elementos-compuestos-y-mezclas/
- Marroquín T. (2021) Nomenclatura Quimica.














Falta agregar más ejemplos
ResponderBorrar