GASES
Principalmente se compone por moléculas que no son atraídas unas por otras, por lo que se
mueven en el vacío a gran velocidad y muy separadas unas de otras.
Los gases poseen distintas propiedades. Sus moléculas se encuentran prácticamente
libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos.
Se conoce como gases nobles o gases inertes al conjunto de elementos químicos que constituyen el grupo 18 (VIIIA) de la Tabla Periódica de los elementos y que presentan una serie de características en común, siendo la más importante su bajísimo grado de reactividad, es decir, su poca capacidad para formar compuestos y estructurar moléculas complejas. Existen apenas algunos compuestos con estos elementos, que se sepa.
Los gases nobles, en condiciones de temperatura y presión normales, son sustancias gaseosas monoatómicas desprovistas de color, olor y sabor, que se hallan presentes en diversa proporción en el aire de la atmósfera y en otras situaciones de la naturaleza.
A pesar de su baja reactividad, o precisamente a consecuencia de ella, los gases nobles poseen diversas aplicaciones en las industrias humanas y son producidos masivamente.
Los gases nobles son siete:
- Helio (He). El segundo elemento más abundante en el universo, producido por reacciones nucleares en el corazón de las estrellas mediante la fusión del hidrógeno. Es muy popular porque altera la voz humana al ser inhalado y porque es mucho más liviano que el aire, por lo que tiende siempre a subir.
- Neón (Ne). Muy abundante en el universo, es lo que da el tono rojo a la luz de lámparas fluorescentes. Se usa en la iluminación por tubos (de neón) y en la tecnología de la TV.
- Argón (Ar). Común en el aire de la atmósfera, es un elemento sumamente empleado como aislante en la industria y en la obtención de láseres distintos.
- Kriptón (Kr). A pesar de ser un gas noble, se sabe que reacciona con el flúor y otras pocas sustancias que poseen fuerte electronegatividad. Tiene seis isótopos (versiones) estables y diecisiete radiactivos.
- Xenón (Xe). Un gas muy pesado, presente en la superficie terrestre apenas en trazas. Fue el primer gas noble sintetizado.
- Radón (Rn). Surge de la desintegración de elementos radiactivos como el radio o el actinio (entonces se le llama actinón), por lo que es un gas noble pero radiactivo, cuyo isótopo más estable lleva una vida media de 3,8 días y luego deviene en Polonio.
- Oganesón (Og). Llamado también eka-radón, Ununoctio (Uuo) o elemento 118, es altamente radiactivo, sintético, descubierto en 2002.
Inicialmente, al ser descubiertos, a estos elementos se los llamó gases inertes o gases raros, pues se pensaba que eran pasivos químicamente y raros en el universo.
Ambas cosas resultaron ser falsas, por lo que se prefiere el uso de “gases nobles”, traducción del término alemán con que Hugo Erdmann los bautizó en 1898: Edelgas.
Este nombre proviene en préstamo de los “metales nobles” como el oro, cuyo comportamiento químico muestra también una tendencia hacia la poca reactividad, es decir, a mantenerse puro.
COMPORTAMIENTO DE LOS GASES NOBLES
los gases nobles son poco reactivos, es decir, poco dados a las uniones entre átomos. Esto significa que no reaccionan mucho con otras sustancias, ni siquiera reaccionan entre átomos del mismo gas, como sí ocurre con gases diatómicos como el oxígeno (O2) o el hidrógeno (H2), que forman moléculas. El helio y el neón resultan particularmente inertes y les siguen el argón, kriptón, xenón y radón.
Las excepciones a esta regla son pocas, e involucran por lo general a los gases nobles más pesados, como el xenón o el radón, capaces de formar compuestos con el flúor y el oxígeno, como el hexafluoruro de kriptón (KrF6) o el ácido xénico (H2XeO4).
Bajo condiciones particulares de temperatura (-60 y -90 °C respectivamente) el kriptón puede enlazarse con el nitrógeno y el oxígeno de manera estable. Ningún compuesto de neón se ha identificado en el universo hasta la fecha.

LEY DE BOYLE
- Boyle descubrió en 1662 que la presión que ejerce un gas es inversamente proporcional a su volumen a temperatura y cantidad de gas constante: P = k / V → P · V = k (k es una constante).
- Por lo tanto: P1 · V1 = P2 · V2
- Lo cual tiene como consecuencia que:
- Si la presión aumenta el volumen disminuye
- Si la presión disminuye el volumen aumenta
LEY DE CHARLES
- Charles descubrió en 1787 que el volumen del gas es directamente proporcional a su temperatura a presión constante: V = k · T (k es una constante).
- Por lo tanto: V1 / T1 = V2 / T2
- Lo cual tiene como consecuencia que:
- Si la temperatura aumenta el volumen aumenta
- Si la temperatura disminuye el volumen disminuye
LEY DE GA-LUSSAC
- Gay-Lussac descubre en 1802 que la presión del gas es directamente proporcional a su temperatura a volumen constante: P = k · T (k es una constante).
- Por lo tanto: P1 / T1 = P2 / T2
- Lo cual tiene como consecuencia que:
- Si la temperatura aumenta la presión aumenta
- Si la temperatura disminuye la presión disminuye
ECUACIÓN DEL GAS IDEAL
La ecuación conocida como ecuación del gas ideal, explica la relación entre las cuatro variables P (Presion), V (Volumen), T (Temperatura) y n (Cantidad de sustancia). Un gas ideal es un gas hipotético cuyo comportamiento de presión, volumen y temperatura se puede describir completamente con la ecuación del gas ideal.
Antes de utilizar la Ecuación necesitamos un valor numérico para R, que se denomina constante de los gases. El valor y las unidades de R dependen de las unidades de P, V, n y T. La temperatura siempre debe expresarse como temperatura absoluta. La cantidad de gas, n, normalmente se expresa en moles. Las unidades preferidas para la presión y el volumen suelen ser atm y litros, respectivamente. Sin embargo, podrían emplearse otras unidades. La manera más sencilla de obtener este valor es sustituyendo el volumen molar de un gas ideal a 0 °C y 1 atm. Sin embargo, el valor de R dependerá de las unidades utilizadas para expresar la presión y el volumen. Con un volumen molar de 22,4140 L y la presión en atmósferas se obtiene lo siguiente:
Hay tres tipos de problemas de Estequiometría de gases:
- Moles-Volúmen (o Volúmen-Moles)
- Peso-Volúmen (o volúmen-peso)
- Volúmen-Volúmen
1.- Calcular el volumen de O2 (en litros) a TPE que se requieren para completar la combustión de 2.65 L de acetileno (C2H2) a TPE.
Analizando el problema podemos darnos cuenta de que la temperatura y la presión permanecen constantes, por lo cual lo único que puede llegar a cambiar son los moles y el volumen.
Para encontrar los moles, vamos a balancear la ecuación química:
Por lo tanto, este problema podríamos resolverlo con la ley de Avogadro de la siguiente forma:
Pero para efectos de este tema, podemos resolver por medio de estequiometría de la siguiente forma:
La ley de las presiones parciales de Dalton se expresa básicamente con el siguiente enunciado:
|
Esto significa que la presión total se puede expresar tal que
Donde representa la presión parcial del i-ésimo componente en la mezcla. Se asume que los gases no tienen reacciones químicas entre ellos, el caso más ideal es con gases nobles.
donde es la fracción molar del i-ésimo componente de la mezcla gaseosa de n componentes.
- Aula Fácil (2018) Estequiometria con gases. https://www.aulafacil.com/cursos/quimica/problemas-de-quimica-general-para-universitarios/estequiometria-con-gases-l40268
- Laboratorio Químico (2019) Leyes de los gases ideales. https://www.tplaboratorioquimico.com/quimica-general/gases/las-leyes-elementales-de-los-gases/la-ecuacion-del-gas-ideal.html
- Juárez Guzmán (2020) Química y ley de gases. https://www.quimicas.net/2015/06/leyes-de-los-gases.html
- Posada Mendoza (2020) Gases nobles y propiedades. https://www.caracteristicas.co/gases-nobles/
- Jimenez Judith (2019) Gases en quimica. https://www.revistapetroquimica.com/gas/
- Lice AGB (2020) Gases, ley de presiones parciales. https://www.liceoagb.es/quimigen/gas6.html
- Morán Cardona (2019) Ley de Dalton. https://www.aulafacil.com/cursos/quimica/problemas-de-quimica-general-para-universitarios/ley-de-dalton-o-de-las-presiones-parciales-l40269









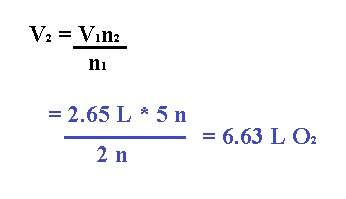
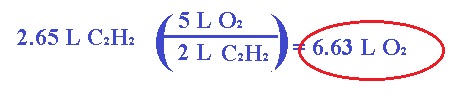






Comentarios
Publicar un comentario