SOLUCIONES
Una solución es una mezcla homogénea cuyos componentes, llamados soluto y solvente, no
pueden ser separados por métodos mecánicos simples (filtración, decantación y centrifugación).
Las soluciones verdaderas constan de un solvente y uno o varios solutos cuyas proporciones
varían de una solución a otra.
SOLUCIÓN = SOLVENTE + SOLUTO
Por definición el solvente es la especie que se encuentra en mayor proporción y el soluto es la
especie en menor proporción. En las soluciones pueden darse diferentes combinaciones en las que
sólidos, líquidos o gases actúen como solutos o como solventes. La clase más común es aquella en
la que el solvente es un líquido; por ejemplo, el agua de mar es una solución acuosa de muchas
sales y algunos gases.
Soluciones líquidas y espontaneidad del proceso de solución
La facilidad del proceso de solución depende de dos factores: 1) del cambio del contenido
energético (exotermicidad o endotermicidad) y 2) del cambio en el desorden (entropía) que
acompaña al proceso.
La ESPONTANEIDAD de un proceso está favorecida por una disminución en
la energía del sistema, lo que corresponde a los procesos exotérmicos, y por un aumento del
desorden del sistema.
Muchos sólidos se disuelven en líquidos mediante procesos endotérmicos.
La razón es que la
endotermicidad es superada por el gran aumento del desorden que acompaña a la solución del
soluto. Las partículas de soluto están muy ordenadas en un retículo cristalino, pero se mueven al
azar en una disolución líquida. Casi todos los procesos de solución se producen con un aumento
del desorden del soluto.
Interacciones a considerar en el proceso de solución
1. Interacciones soluto-soluto
2. Interacciones solvente-solvente
3. Interacciones solvente-soluto
El proceso de solución es más favorable cuando los dos primeros factores son relativamente
pequeños y el tercero grande.
Efecto de la temperatura y presión sobre la solubilidad
Por convención un proceso exotérmico es aquel donde se libera calor al medio ambiente y un
proceso endotérmico es aquel que absorbe calor desde el medio, como se verá más adelante en
otro capítulo (termodinámica).
- Exotérmico: reactivos → productos + calor
- Endotérmico: reactivos + calor → productos
TIPOS DE SOLUCIONES
Diluidas. Cuando la cantidad de soluto respecto al solvente es muy pequeña. Por ejemplo: 1 gramo de azúcar en 100 gramos de agua.Concentradas. Cuando la cantidad de soluto respecto al solvente es grande. Por ejemplo: 25 gramos de azúcar en 100 gramos de agua.Saturadas. Cuando el solvente no acepta ya más soluto a una determinada temperatura. Por ejemplo: 36 gramos de azúcar en 100 gramos de agua a 20 °C.Sobresaturadas. Como la saturación tiene que ver con la temperatura, si incrementamos la temperatura, se puede forzar al solvente a tomar más soluto del que ordinariamente puede, obteniendo una solución sobresaturada (saturada en exceso, digamos). Así, sometida a un calentamiento, la solución tomará mucho más soluto del que ordinariamente podría.
FACTORES QUE AFECTAN LA DISOLUCIÓN
- Temperatura
- Presión
- Agitación
- Polaridad
- Tamaño de partícula
Además se debe tomar en
cuenta:
- Interacción DisolventeDisolvente
- Interacción Soluto- Soluto
- Interacción DisolventeSoluto.
REGLAS DE SOLUBILIDAD
1.- Son solubles las sales de los elementos del grupo 1, metales alcalinos. También son solubles las
sales que contienen al ión amonio (NH4
+
).
2.- Son solubles las sales que contienen al anión nitrato, NO3
-
.
3.- Las sales que contienen los aniones Cl-
, Bry Ison, en general, solubles. A excepción de las sales
que estos aniones forman con los cationes Ag+
, Pb2+ y Hg2+
.
4.- La mayoría de los sulfatos son solubles, con excepción de los sulfatos de Ba2+, Pb2+, Ag+
y Sr2+
.
5.- La mayoría de los hidróxidos son poco solubles, excepto los de los metales alcalinos.
6.- Los sulfuros son muy poco solubles, excepto los de los metales alcalinos.
7.- Existen varios carbonatos muy poco solubles, como los de los elementos del grupo 2 y los de
Fe2+ y Pb2+
.
8.- Muchos cromatos, fosfatos y fluoruros son insolubles. Ejemplos: PbCrO4, BaCrO4, Ca3(PO4)2,
Ag3PO4, BaF2, MgF2, PbF2.
UNIDADES DE CONCENTRACION
El estudio cuantitativo de una disolución
requiere que se conozca su concentración,
es decir, la cantidad de soluto presente en
determinada cantidad de disolución.
Porcentajes (%p/p,
%p/v,
%v/v)
Determine la concentración (%p/v) de una solución de azúcar en la que se pesó 567 gr y el volumen final fue de 0.98 L.
- % p/v = 567 g / 980 * 100 = 57.68% p/v
NORMALIDAD
La concentración normal o normalidad (N), se define como el número de equivalentes de soluto por litro de solución
No expresa la cantidad de soluto presente utilizando unidades de
materia (moles), sino utilizando unidades de materia (moles),
sino utiliza número de unidades de reacción (equivalentes).
EQUIVALENTE
Es la cantidad de una sustancia que
representa una unidad de reacción en un
proceso químico en particular
La ventaja de trabajar con equivalentes, es
que las relaciones siempre son de 1:1, al
contrario de cuando se trabaja con moles.
Dado que el concepto de equivalente le
señala como unidad de reacción, el mismo
dependerá del tipo de reacción en el cual la
disolución tome parte.
 POR EJEMPLO
POR EJEMPLO
- Calcular la normalidad y la molaridad de 50 gramos de Na2CO3 en 100 ml de disolución:
- Normalidad (N):
- Peso molecular del Na2CO3 = 106
- Equivalente del Na2CO3 = peso molecular / nº de carga del catión de la sal = 106 / 2 = 53
- nº de Equivalentes en 50 g de Na2CO3 = 50 / 53= 0,94
- N = nº de Equivalentes / litros de disolución = 0,94 / 0,1 = 9,4 N
MOLALIDAD
Es una forma de medir la concentración de soluto en disolvente, es decir, el número de moles de soluto presente en el disolvente.
La molalidad, también conocida como concentración molal o concentración en la cantidad de materia por masa, se usa cuando las soluciones tienen temperaturas variables.
Esto se debe a que su cálculo no requiere volumen, que puede variar debido a la variación de temperatura. Su uso también se valora en el estudio de las propiedades coligativas.
 POR EJEMPLO
POR EJEMPLO
Ejemplo 1: calcular la molalidad de una disolución de ácido sulfúrico H2SO4 siendo la masa del disolvente de 600 gramos y la cantidad de ácido de 60 gramos.
Datos: peso molecular del H2SO4 = 98 gramos / mol.
En primer lugar calculamos el número de moles y a partir de ahí obtenemos la molalidad:
- n de H2SO4 = masa / peso molecular =60
gramos / 98 gramos · mol-1 = 0,61 moles - m = n / masa disolvente = 0,61 moles / 0,6 kg = 1,02 molal
MOLARIDAD
La molaridad o concentración molar de un soluto se define como el número de moles del soluto por litro de solución. La molaridad tiene unidades de mol/litro que pueden abreviarse como M.
 POR EJEMPLO
POR EJEMPLO
Para una disolución de 0.5 litros de Hidróxido de Magnesio [Mg(OH)2], y si el Peso Molecular del Hidróxido de Magnesio es de 58 g/mol. Se tienen 36 gramos de éste.
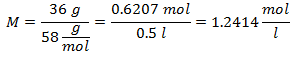
PARTES POR MILLÓN
Son las partes de masa de soluto por un millón de partes de masa de solución.
Esta concentración se utiliza para soluciones muy diluidas como en el análisis de agua o preparaciones biológicas.
En estas soluciones muy diluidas, su densidad es muy cercana a la del agua y se supone que la densidad de la solución es de 1.00 g/mL. Por lo anterior, se puede hacer la simplificación de mg soluto/Litro de solución.
DILUCIONES
En química, la dilución es la reducción de concentración de una sustancia química en una disolución.
La dilución consiste en rebajar la cantidad de soluto por unidad de volumen de disolución. Se logra adicionando más diluyente a la misma cantidad de soluto: se toma una poca porción de una solución alícuota y después esta misma se introduce en más disolvente.
Esto se deduce al pensar que tanto la disolución en un principio como al final contará con la misma cantidad de moles. Por definición mol (m) es:

La concentración de una disolución es la proporción o relación que hay entre la cantidad de soluto y la cantidad de disolución o, a veces, de disolvente; donde el soluto es la sustancia que se disuelve, el solvente es la sustancia que disuelve al soluto, y la disolución es el resultado de la mezcla homogénea de las dos anteriores. Por menor proporción de soluto disuelto en el solvente, menos concentrada está la solución, y a mayor proporción más concentrada está.
 POR EJEMPLO
POR EJEMPLO
Se disponen de 10 mL de una disolución de cloruro de sodio (NaCl) 1 mol/L. A partir de esta disolución se desea preparar una disolución de NaCl 0,1 mol/L de concentración. Calcula el volumen de disolución de NaCl 0,1 mol/L que se debería obtener.
Conocemos los siguientes datos, el volumen de la solución inicial que se utilizó para preparar la solución diluida de NaCl (V1=10 ml), la concentración de la solución inicial de NaCl (C1=1 M), y la concentración final (solución diluida, C2=0,1 M) que se obtuvo.
Despejando para V2-->
V2=C1*V1/C2
Sustituyendo los valores:
V2= (1 M)*(10mL)/(0,01M)
V2= 100 mL
\dfrac{\text {mol}}{\text {litro}}
PROPIEDADES COLIGATIVAS
Las propiedades coligativas dependen de la concentración del soluto y no de la naturaleza de sus moléculas. No guardan ninguna relación con el tamaño ni con cualquier otra propiedad de los solutos. Son función sólo del número de partículas.
- Disminución de la Presión de vapor
- Elevación de la temperatura de ebullición
- Reducción de la temperatura de congelación.
- Presión osmótica.
Disminución de la presión de Vapor
La presión de vapor de un disolvente desciende cuando se le añade un soluto no volátil. Este efecto es el resultado de dos factores:
- La disminución del número de moléculas del disolvente en la superficie libre.
- La aparición de fuerzas atractivas entre las moléculas del soluto y las moléculas del disolvente, dificultando su paso a vapor.
Si un soluto es no volátil la presión de vapor de su disolución es menor que la del disolvente puro. Así que la relación entre la presión de vapor y presión de vapor del disolvente depende de la concentración del soluto en la disolución. Esta relación está dada por la ley de Raoult, que establece que la presión parcial de un disolvente sobre una disolución está dada por la presión de vapor del disolvente puro, multiplicada por la fracción molar del disolvente en la disolución.
Una fuerza motora en los procesos físicos y químicos es el incremento del desorden: a mayor desorden creado, más favorable es el proceso. La vaporización aumenta el desorden de un sistema porque las moléculas en el vapor no están tan cercanamente empacadas y por lo tanto tienen menos orden que las del líquido.
Elevación de la temperatura de Ebullición
La temperatura de ebullición de un líquido es aquélla a la cual su presión de vapor iguala a la atmosférica.
Cualquier disminución en la presión de vapor (como al añadir un soluto no volátil) producirá un aumento en la temperatura de ebullición. La elevación de la temperatura de ebullición es proporcional a la fracción molar del soluto. Este aumento en la temperatura de ebullición (DTe) es proporcional a la concentración molal del soluto:
DTe = Ke m
La constante ebulloscópica (Ke) es característica de cada disolvente (no depende de la naturaleza del soluto) y para el agua su valor es 0,52 ºC/mol/Kg. Esto significa que una disolución molal de cualquier soluto no volátil en agua manifiesta una elevación ebulloscópica de 0,52 º C.
Reducción del punto de congelación
La presión de vapor más baja de una solución con relación al agua pura, también afecta la temperatura de congelamiento de la solución, esto se explica porque cuando una solución se congela, los cristales del solvente puro generalmente se separan; las moléculas de soluto normalmente no son solubles en la fase sólida del solvente. Por ejemplo cuando soluciones acuosas se congelan parcialmente, el sólido que se separa casi siempre es hielo puro, como resultado la presión de vapor del sólido es la misma que para el agua líquida pura.
La temperatura de congelación de congelación de una solución es la temperatura a la cual comienzan a formarse los cristales de solvente puro en equilibrio con la solución. Debido a que el punto triple de la temperatura de la solución es más bajo que el del líquido puro, la temperatura de congelamiento de la solución también será más bajo que el del agua líquida pura.
La congelación se produce cuando la presión de vapor del líquido iguala a la presión de vapor del sólido. Llamando Tc al descenso crioscópico y m a la concentración molal del soluto, se cumple que:
DTc = Kc m
Siendo Kc la constante crioscópica del disolvente. Para el agua, este valor es 1,86 ºC/mol/Kg. Esto significa que las disoluciones molales (m=1) de cualquier soluto en agua congelan a -1,86 º C.
Presión Osmótico y Osmosis
La presión osmótica es la propiedad coligativa más importante por sus aplicaciones biológicas.
Se define la presión osmótica como la tendencia a diluirse de una disolución separada del disolvente puro por una membrana semipermeable. Un soluto ejerce presión osmótica al enfrentarse con el disolvente sólo cuando no es capaz de atravesar la membrana que los separa. La presión osmótica de una disolución equivale a la presión mecánica necesaria para evitar la entrada de agua cuando está separada del disolvente por una membrana semipermeable.
COLOIDES
En física y química los coloides, sistemas coloidales o suspensiones coloidales son un tipo de mezcla, generalmente compuesto por una fase fluida o continua (líquida o gaseosa) y otra dispersa (generalmente sólida) en partículas muy pequeñas y muy finas (con un diámetro de entre 10-9 y 10-5 m), que no pueden verse a simple vista.
Esto último los distingue de las suspensiones químicas, así como el hecho de que al estar mucho rato en reposo las fases de una suspensión tienden a separarse, pero no así las de un coloide.
La palabra coloide proviene del vocablo griego kolas, que significa “que puede pegarse”, lo que hace referencia directa a la tendencia de los coloides a formar coágulos y a adherirse a otras sustancias. Por lo tanto, pueden alterar las propiedades de otras sustancias con las que entran en contacto, es decir, son potencialmente contaminantes.
Podría decirse que los coloides están en un lugar intermedio entre disoluciones y suspensiones.
TIPOS DE COLOIDES
Coloides líquido (fase dispersa) en gas (fase continua). Forman aerosoles líquidos, como la niebla, la bruma o la neblina.Coloides sólido (fase dispersa) en gas (fase continua). Forman aerosoles sólidos, como el humo de un incendio, el polvo en el aire, o la ceniza volcánica en la atmósfera.Coloides gas (fase dispersa) en líquido (fase continua). Forman espumas, como la de la cerveza o la espuma del afeitado.Coloides líquido (fase dispersa) en líquido (fase continua). Forman emulsiones, como la leche, la mayonesa o las cremas corporales cosméticas.Coloides sólido (fase dispersa) en líquido (fase continua). Forman soles (singular: “sol”, por ejemplo, la sangre es un sol), como las pinturas o la tinta china.Coloides gas (fase dispersa) en sólido (fase continua). Forman espumas sólidas, como el merengue o los aerogeles, o la piedra pómez.Coloides líquido (fase dispersa) en sólido (fase continua). Forman geles, como la gelatina, el queso o la gominola.Coloides sólido (fase dispersa) en sólido (fase continua). Forman soles sólidos, como los cristales de rubí.
 POR EJEMPLO
POR EJEMPLO
El polvo que flota en el aire. Cuando limpiamos una habitación vieja, el mismo que podemos ver cuando entra un rayo de luz por la ventana.Los aerosoles. Con los que se pinta grafitis son gotas de pintura pulverizada en una base fija.La sangre. Es un sistema coloidal de proteínas, células y sustancias que le proveen su espesor o ligereza.La gelatina. Hecha con cartílago animal, forma un gel a determinadas temperaturas.
REFERENCIAS BIBLIOGRAFICAS - Marroquín Tinti (2021) Clase Magistral / Soluciones.
- Monzón Hernán (2018) Concentraciones. https://www.quimica.es/enciclopedia/Concentraci%C3%B3n.html
- Aguilar López (2019) Coloides. https://concepto.de/coloide/
- EcuRed (2017) Propiedades Coligativas. https://www.ecured.cu/Propiedades_coligativas
- Juárez Lima (2021) Diluciones quimicas https://tucursodeingenieria.blogspot.com/2020/05/dilucion-de-las-soluciones-concentradas.html
- Química Virtual (2019) Normalidad, Molalidad, Molaridad. https://www.quimicas.net/2015/05/ejemplos-de-normalidad.html
- USAC (2020) Guía de soluciones y reglas de solubilidad. https://uft.cl/images/futuros_alumnos/profesores_orientadores/material-pedagogico/Guia_5_Soluciones.pdf
 POR EJEMPLO
POR EJEMPLO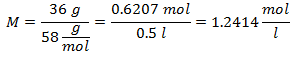












Comentarios
Publicar un comentario